Nel 2020 Emmanuelle Charpentier e Jennifer Doudna sono state le prime due donne a condividere il premio Nobel per la Chimica per la rivoluzionaria scoperta che permette la manipolazione precisa e mirata del DNA.
Charpentier e Doudna hanno scoperto uno degli strumenti più efficaci della tecnologia genetica. Usando queste “forbici del genoma”, i ricercatori oggi possono cambiare il DNA di animali, piante e microrganismi con una precisione estremamente alta.
Tutto nasce da una telefonata che la biochimica Doudna fa alla collega francese Charpentier quando viene a conoscenza del suo lavoro sulle molecole di RNA che ben si adatta alle sue ricerche sul ribozima.
La scoperta
Nel batterio Streptococcus pyogenes, beta-emolitico del gruppo A responsabile di infezioni diffuse e anche gravi, esiste uno strumento di difesa, rappresentato da una endonucleasi, la proteina Cas9 con RNA guida che agisce da forbice molecolare aiutando questo batterio, così come altri batteri che la contengono, a proteggersi da virus patogeni e svolgendo, quindi, la funzione di una sorta di sistema immunitario.
Questa scoperta fece nascere nelle due scienziate l’idea di come questo meccanismo potesse rivoluzionare le biotecnologie.
Tra il 2012 e il 2013, nasce così una collaborazione a distanza tra i due Istituti di ricerca uno in America e l’altro in Francia dove, rispettivamente, le ricercatrici lavorano. Il loro obiettivo è quello di prendere in prestito dai batteri questo sistema di difesa, per applicarlo come strumento biotecnologico per tagliare specifiche sequenze di DNA all’interno del genoma di una cellula non batterica.
Il sistema CRISPR/Cas9
La tecnica si basa sul taglio che introdotto da Cas9, attraverso opportuni accorgimenti, renda possibile eliminare sequenze di DNA dannose dal genoma bersaglio o renda possibile sostituire delle sequenze, la cui eliminazione sia necessaria per correggere delle mutazioni che causano malattie.
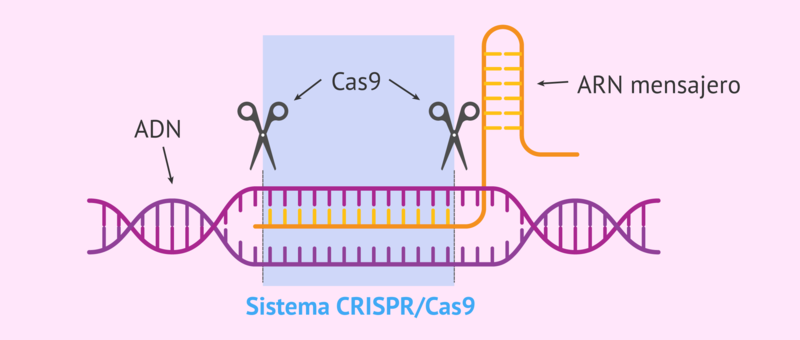
La programmazione del bersaglio di Cas9 avviene attraverso una molecola di RNA, chiamata RNA guida, che può essere facilmente modificata in laboratorio e una volta associata a Cas9, agisce come una specie di guinzaglio, ancorandola alla sequenza di DNA bersaglio scelto.
Questa scoperta è stata una vera e propria rivoluzione per la ricerca biomedica, poiché per la prima volta si è riusciti ad introdurre modificazioni desiderate nel genoma in modo semplice, efficace, veloce ed economico. A dimostrazione di ciò CRISPR/Cas9 in pochi anni si è diffuso nei laboratori di tutto il mondo e viene oggi impiegato sia per la ricerca di base che per scopi applicativi. Infatti, pur essendo una tecnologia ancora relativamente nuova e in forte evoluzione, la sua robustezza la sta spingendo rapidamente verso la sperimentazione clinica.
Pubblicata su SCIENZE nel 2012 sotto la firma di Doudna e Charpentier e collaboratori, porterà le due ricercatrici ad ottenere il Nobel per la Chimica nel 2020.
L’avvento di CRISPR/Cas9 ha per la prima volta reso sensato ipotizzare il trattamento di tutta una serie di patologie a base genetica per cui prima non era neppure possibile concepire un approccio terapeutico.
Nell’ambito della ricerca e sviluppo, questa tecnologia sta permettendo di scoprire molto rapidamente nuovi target molecolari per terapie avanzate e Amgen, un’azienda leader nella ricerca biotecnologica sul genoma umano, ha introdotto questo strumento nei diversi campi di ricerca in cui è impegnata per contrastare le patologie più severe.
Malattie come l’anemia falciforme, data dalla presenza di una tripletta mutata, che sostituisce, nella catena polipeptidica dell’emoglobina, l’amminoacido detto acido glutammico con un altro amminoacido detto valina, determinando un’alterazione conformazionale dell’emoglobina e del globulo rosso, che da lente biconcava assume una forma a falce. Tale struttura porta all’ostruzione dei capillari, che con il progredire del tempo, comporta il malfunzionamento di vari organi ed una morte prematura.
Altre patologie che tale tecnica potrebbe risolvere sono: il diabete con l’introduzione del gene codificante per l’insulina, l’emofilia grazie all’aggiunta sul cromosoma X dei geni responsabili delle proteine del fattore VIII (Emofilia A) e del fattore IX (Emofilia B), la distrofia muscolare di Duchene risolvibile con l’aggiunta del gene sintetizzante la distrofina, etc.
La rivoluzione Crisp è arrivata anche nei laboratori dedicati allo studio di tumori e malattie genetiche nell’uomo. Grazie al sistema CRISP-Cas9 è diventata realtà la possibilità di realizzare animali geneticamente modificati che presentano specifiche mutazioni associate a malattie umane.
È possibile, così, utilizzare animali che possono replicare le malattie umane in modo da da poter sperimentare le cure come è successo, nel 2016 in Cina dove c’è stato il primo caso di uso del sistema CRISP-Cas9 per strumento terapeutico nell’uomo.
Solo l’immaginazione può porre dei limiti alle sue applicazioni
ha spiegato l’Accademia svedese delle scienze per motivare il premio, spiegando che Charpentier e Doudna hanno “scoperto uno degli strumenti più efficaci della tecnologia genetica.
Biografie



